Link zum ersten Teil dieser Artikelreihe.
Die deutsche Arzneimittelaufsichtsbehörde, das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) entstand Anfang der 90er Jahre aus dem Bundesgesundheitsamt (BGA). Damals in den 80er Jahren – die älteren Leser werden sich hieran sicher erinnern – erschütterte ein Arzneimittelskandal die Republik und führte zur Auflösung der alten und zum Entstehen der neuen Aufsichtsbehörde. Es ging um Blutkonserven, die mit dem HIV-Virus verseucht waren. Sie wurden Blutern verabreicht, die infolgedessen an Aids erkrankten und vielfach daran verstarben.
Ende September 1993 erfuhr der damalige Bundesgesundheitsminister Horst Seehofer, dass das Bundesgesundheitsamt schon seit Mai 1993 von HIV-positiven Blutplasmakonserven der Firma UB Plasma wusste, aber nichts unternommen hatte (1). Wenige Tage später entließ er den damaligen BGA-Präsidenten Dieter Großklaus. Im Abschlussbericht des Untersuchungsausschusses des Deutschen Bundestages wurde festgestellt, „dass rund 60 Prozent der durch kontaminierte Blutprodukte ausgelösten HIV-Infektionen hätten verhindert werden können“.
Ferner wurde kritisiert, „dass es dem Bundesminister nicht gelungen ist, den nach der Contergan-Katastrophe für Arzneimittel-Großrisiken geschaffenen Pharmapool zu Leistungen an die Stiftung (für durch Blutprodukte HIV-infizierte Personen) heranzuziehen (…) (obwohl) der Pool mit über 800 Millionen DM über mehr als ausreichende Mittel verfügt“ (2).
In die Zeit des Übergangs von der alten Aufsichtsbehörde BGA hin zur heutigen Aufsichtsbehörde BfArM fiel auch die Zulassung zahlreicher Antidepressiva, der so genannten Selektiven Serotonin Wiederaufnahmehemmer – Selektive Serotonin Reuptake Inhibitors –, kurz SSRI-Antidepressiva.
Dass diese Medikamente in allen westlichen Staaten überhaupt die Zulassung erhalten haben, obwohl schon zu Beginn erhebliche Sicherheitsrisiken, insbesondere zum Suizidrisiko, erkennbar waren – kann das ohne aggressives Marketing und die Einflussnahme auf Entscheidungsträger wirklich erklärbar sein?
Wie dies gemacht wurde, zeigt in besonders eindringlicher Weise das Beispiel Prozac, oder Fluctin, wie das Medikament in Deutschland heißt.
Prozac, der erste SSRI-Blockbuster
Prozac war das erste in Deutschland zugelassene SSRI-Antidepressivum und der Beginn einer neuen Ära von Medikamenten, der so genannten Blockbuster-Präparate. Das heißt, dass dieses Medikament allein einen Umsatz von mehr als einer Milliarde US-Dollar erzielte. Doch bis es soweit war, dass Prozac beziehungsweise Fluctin in Deutschland über den Ladentisch der Apotheken gereicht und von den Ärzten verschrieben werden konnte, war es ein langer Weg, der einiges an „Überzeugungsarbeit“ bei Meinungsführern und Entscheidern erforderte.
Wie diese aussah, darüber konnte John Virapen ein Liedchen singen. Virapen, ein ehemaliger Pharmamanager bei Eli Lilly – der US-Firma, die Prozac entwickelt hatte – lebte zuletzt in Deutschland und verstarb leider vor einigen Jahren. Ich hatte ihn in den Jahren 2008 bis 2009 einige Male am Telefon gesprochen. In seinem Buch über seine Zeit bei Eli Lilly (3) schreibt er, wie er Kontakt zu dem für Prozac zuständigen Gutachter aufgenommen hatte, um die Zulassung zu erreichen. Bei einem gemeinsamen Essen wurde dann auch über Geld gesprochen. „In Deutschland müsse es ähnlich gelaufen sein“, erzählte er mir am Telefon.
Doch noch Mitte der 80er Jahre waren die Beamten der deutschen Zulassungsbehörde standhaft und versagten Prozac beziehungsweise Fluctin zweimal die Zulassung. In einem Fax von Eli Lilly an die amerikanische Zentrale aus dem Jahr 1984 hieß es, dass das BGA das Medikament für vollkommen ungeeignet hielt zur Behandlung von Depressionen (4). Den Bericht der Aufsicht erhielt die deutsche Niederlassung von Eli Lilly auf „inoffiziellem“ Weg. Wie wir heute wissen (5), hatte das Unternehmen einen Spitzel in der deutschen Zulassungsbehörde, der die Firma über wichtige interne Vorgänge informierte. Besonders besorgt war die deutsche Aufsicht wegen des erhöhten Suizidrisikos und der Schwere der Nebenwirkungen unter Prozac (Fluctin):
„The frequency of side-effects was very high (partly more than 90 %) and the side-effects resulted in nearly each study in drop-outs. (…) During the treatment with the preparation 16 suicide-attempts were made, 2 of these with success. As patients with the risk of suicide were excluded from the studies, it is probable that this high proportion can be attributed to an action of the preparation in the sense of a deterioration of clinical condition, which reached its lowest point” (4).
Die deutsche Aufsichtsbehörde forderte daher von Eli Lilly detaillierte Informationen zu den Suiziden und Fällen von Suizidalität an und erhielt im Dezember 1986 die angefragten Informationen (6). In einer Studie mit 1.427 Probanden versuchten 16, sich das Leben zu nehmen, zwei mit „Erfolg“ (5). Die starken Bedenken des Bundesgesundheitsamtes konnten somit nicht ausgeräumt werden und daher wurde die Zulassung im April 1988 ein zweites Mal verweigert (7).
Jedoch keine zwei Jahre später wurde die Zulassung im Januar 1990 erteilt. Das Votum der Kommission war einstimmig. Was war geschehen? Der für Antidepressiva zuständige Berichterstatter und Gutachter der Kommission war Professor Hans Jürgen Möller. Seine Meinung war maßgeblich für die Entscheidung der Kommission über den Zulassungsantrag. Gegenüber der Süddeutschen Zeitung hatte er auf Nachfrage eingeräumt, dass er Kontakt zu dem Antragsteller Eli Lilly hatte, aber nur um den Vorgang zu beschleunigen, was aber dennoch streng verboten war.
Der Vorsitzende der Kommission Roland Gugler meint heute, dass er Möller gegen einen neutralen Experten ausgetauscht hätte, hätte er von seinen Kontakten zum Antragsteller gewusst. „Ich habe heute den starken Eindruck, dass die Meinung des Rapporteurs (Möller) damals gefärbt war“, so Gugler in der SZ (5).
Der Name Möller begegnete mir auch in den Akten zu Zoloft, jenem Antidepressivum, das meine Frau vor ihrem Suizid eingenommen hatte. Bei Zoloft saß er nicht nur in der Kommission, die über die Zulassung entscheiden sollte, sondern er hat auch das Gutachten für das pharmazeutische Unternehmen Pfizer zu Zoloft geschrieben.
Ein Blick hinter den Vorhang
Einen Einblick in das Gutachten erhielt ich im Juni 2009, fast drei Jahre nachdem ich bei der deutschen Aufsichtsbehörde BfArM einen Antrag auf Akteneinsicht gestellt hatte. Das Pharmaunternehmen Pfizer hatte zuvor immer wieder versucht, die Einsichtnahme in die Zulassungsunterlagen zu verhindern – jedoch ohne Erfolg.
Am Termin zur Akteneinsicht bei der Aufsichtsbehörde war ein Anwalt des Unternehmens Pfizer anwesend und wachte genau über die Einhaltung der Vorschriften. Wir durften uns zum Beispiel keine Kopien machen, sondern nur handschriftliche Notizen anfertigen, konnten jedoch die gewünschten Unterlagen mit einem Stempel kennzeichnen, von denen wir dann später eine Kopie erhielten.
Von der Aufsichtsbehörde war neben einem Juristen auch der für Psychopharmaka zuständige Abteilungsleiter anwesend: Professor Karl Broich, der heutige Präsident des BfArM . Er informierte uns über den weiteren Ablauf und erklärte, dass die Unterlagen nur für mich und die Klage bestimmt seien und nicht an die Presse weitergegeben werden dürften. Die Einsichtnahme sei mir nur aufgrund meiner Klage vor Gericht gestattet worden; die Informationen dürften daher auch nur hierfür verwendet werden.
Gemäß meinem Anwalt Jörg Heynemann, der bei dem Termin dabei war, gibt es für diese Vorbedingung kein Gesetz und keine Rechtsgrundlage, ich müsse mich daher auch nicht hieran halten.
Zulassungsantrag von Zoloft
In den Unterlagen zu Zoloft bei der Aufsichtsbehörde fanden sich neben dem Gutachten auch der Zulassungsantrag sowie Berichte zu den Studien, die mit Zoloft durchgeführt worden waren. Insgesamt waren es circa 70 Aktenbände, denen ich mich gegenüber sah und für die wir zwei Tage Zeit hatten. Ein fast hoffnungsloses Unterfangen, wenn man nicht weiß, wo genau man anfangen und suchen soll.
Glücklicherweise haben mich nicht nur die Tochter meiner verstorbenen Frau und mein Anwalt bei der Sichtung der Akten unterstützt, sondern wir hatten auch fachkundige Unterstützung durch den früheren Vorsitzenden der Arzneimittelkommission der deutschen Ärzteschaft AkdÄ, Professor Bruno Müller-Oerlinghausen. Ich hatte auch ihn nach dem Tod meiner Frau angeschrieben und er hat mich seitdem unterstützend begleitet. Er wusste, worauf es in erster Linie ankam und auf welche Akten wir uns fokussieren sollten.
Als Erstes nahmen wir uns die Handakten der Korrespondenz zwischen der Zulassungsbehörde und dem pharmazeutischen Unternehmen sowie das Gutachten von Professor Möller vor.
Warnhinweis beunruhigt Patienten nur, ist daher nicht nötig
Aus der Korrespondenz ging unter anderem hervor, dass die Aufsichtsbehörde von dem Unternehmen zunächst gefordert hatte, dass es auch in der Packungsbeilage für die Patienten einen Warnhinweis geben sollte. Dieser müsste darauf hinweisen, dass suizidgefährdete Patienten besonders überwacht werden sollten und, da das Medikament Zoloft nicht dämpfend wirkt, die Verabreichung eines dämpfenden Arzneimittels erforderlich sein könnte.
Doch dem entgegnete Pfizer, dass man die Patienten hiermit nur beunruhigen und als suizidal stigmatisieren würde. Es reiche doch, wenn die Ärzteschaft ausreichend informiert würde, so die Ansicht des Unternehmens.
Ein entsprechender Hinweis in der Fachinformation für die Ärzte würde somit genügen.
Von der Aufsichtsbehörde wurde diese Argumentation akzeptiert und so enthielt der Beipackzettel auch fast 10 Jahre nach der Zulassung, im April 2005, als meine Frau Zoloft verschrieben bekam, keinen Hinweis zum Suizidrisiko, weder bezüglich des Medikaments noch bei Depressionen.
Nach dem Tod meiner Frau erfuhr ich, dass die amerikanische Aufsichtsbehörde, die Food and Drug Administration (FDA), ein halbes Jahr vorher die Pharmaunternehmen dazu verpflichtet hatte, für alle SSRI-Antidepressiva einen Hinweis zum Suizidrisiko schwarz umrandet als Black Box auf jeder Verpackung anzubringen (8). Auch hatte die Arzneimittelkommission der deutschen Ärzteschaft im Herbst 2004 im Ärzteblatt über ein möglicherweise erhöhtes Suizidrisiko durch SSRI-Antidepressiva berichtet (9). Doch bei der deutschen Aufsicht geschah in dieser Zeit nichts.
Erster Antrag von 1991 für Zoloft scheiterte
Ich erfuhr auch, dass dem Medikament Zoloft im Jahr 1991 die Zulassung versagt wurde (10), da es nicht ausreichend an stationären Patienten getestet worden war und es keine Studien zur Bestimmung der kleinsten effektiven Dosis gab.
Diese Datenlage hatte sich seit 1991 bis zum Zeitpunkt des zweiten Antrags auch nicht geändert, wie ein Mitarbeiter der Aufsichtsbehörde bemerkte (11).
Inzwischen waren jedoch andere Antidepressiva zugelassen worden – mit schlechterer Dokumentation als bei Zoloft. Dies empfand man bei der Zulassungsbehörde dem Medikament Zoloft gegenüber als „ungerecht“ (11). Der Kommissionsgutachter für das andere Antidepressivum, dessen Name in den Unterlagen geschwärzt war, erklärte am 9. Oktober 1995 auf der Sitzung der A-Kommission, dass „eine minimal effektive Dosis für Antidepressiva nicht feststellbar sei“ (12). Die Ansicht über die Zulassungskriterien hatte sich also geändert – und somit war der Weg frei für die Zulassung von Zoloft.
Sitzung 197 der A-Kommission zu Zoloft
Ein Jahr später, am 07. Oktober 1996 wurde auf der 197. Sitzung der A-Kommission (13) erneut über die Zulassung von Zoloft mit dem Wirkstoff Sertralin entschieden, also 5 Jahre, nachdem der erste Antrag gescheitert war. Hans Jürgen Möller hatte im Auftrag von Pfizer das neue Gutachten zu Zoloft geschrieben und war auch Mitglied der Kommission, die über die Zulassung entschied. An dieser 197. Sitzung nahm er aber nicht teil. Er hatte noch vorher die Sitzung verlassen.
Seine Teilnahme war auch nicht nötig, konnte er doch sicher sein, dass der Antrag diesmal durchkommt. Er hatte vorher ausreichend Gelegenheit gehabt, seine Kollegen über das Gutachten und in Gesprächen zu überzeugen. Zu einer Diskussion kam es diesmal daher gar nicht erst. Sie war auch nicht gewünscht, wie es im Protokoll vermerkt ist, denn es bestand Einigkeit zwischen dem Institut, das heißt der Zulassungsbehörde, und der Kommission. Dafür hatte Möller durch seine direkten Kontakte zu der Mitarbeiterin bei der Aufsichtsbehörde gesorgt (14), die den Zulassungsantrag bearbeitete. Das Votum der Kommission fiel entsprechend eindeutig aus mit 20:0 für die Zulassung bei keiner Enthaltung (13).
Keine wissenschaftliche Prüfung des Risikos im Gutachten
Die Aufgabe des Gutachtens im Zulassungsverfahren ist es, die im Antrag vom Unternehmen vorgelegten Ergebnisse aus Studien kritisch zu überprüfen und zu beurteilen, ob das beantragte Medikament wirksam und sicher ist. Es muss also eine Risiko-Nutzen-Bewertung nach dem aktuellen Stand der Datenlage und der Wissenschaft vorgenommen werden. Das schreibt das Gesetz vor. Dabei sollte der Gutachter unabhängig und frei von Interessenskonflikten sein.
Dem von Professor Möller verfassten Gutachten (15) kann man keine dieser Anforderungen bescheinigen. Weder war Möller unabhängig – war er doch im Auftrag des Pharmaunternehmens Pfizer tätig und hatte darüber hinaus zahlreiche Beratungsmandate bei verschiedenen anderen Pharmaunternehmen (16) – noch wurden im Gutachten alle verfügbaren und relevanten Daten bei der Bewertung mit einbezogen.
Die Bewertung des Suizidrisikos von Zoloft im Gutachten hatte Bruno Müller-Oerlinghausen als erster in dem Aktenberg entdeckt. Als er die Zahlen sah, war er erstaunt: Dies müsste doch signifikant sein, auch ohne es im Detail nachzurechnen. Was meinte er hiermit und wie kam er hierauf? Im Gutachten war festgehalten, dass die Gesamtzahl der Probanden aus klinischen Studien, die das Medikament Zoloft verabreicht bekamen, 16.940 betrug – eine erstaunlich große Anzahl. Ein Vergleichsmedikament oder ein wirkstoffloses Placebo erhielten 9.016 Probanden. Eher beiläufig hieß es im Gutachten, dass unter Zoloft bei 0,09 Prozent der Probanden suizidale Handlungen festgestellt wurden, während in der Kontrollgruppe dies bei 0,02 Prozent der Fall war (17 ).

In Relation zur Größe der Gruppen war die Anzahl der Fälle von suizidalen Handlungen unter Zoloft also circa 4 mal so groß wie in der Kontrollgruppe. Aufgrund der großen Anzahlen der in beiden Gruppen getesteten Probanden kann dies kein Zufall sein und deutet auf ein größeres Risiko unter Zoloft hin.
Wer sich in Statistik etwas auskennt, weiß, was damit gemeint ist, dass „dies schon signifikant sein müsse“. Professor Müller-Oerlinghausen war sich aufgrund der Zahlen in seiner Aussage sicher, dass die Wahrscheinlichkeit eines Irrtums höchstens 5 Prozent beträgt. Möglicherweise ist das Irrtumsrisiko sogar noch geringer.
Auch wenn ich der gleichen Ansicht war und dies später zu Hause mit verschiedenen statistischen Test bestätigen konnte, so war ich zunächst etwas überrascht wegen der insgesamt geringen Anzahlen. Denn rechnet man die Prozentangaben aus, waren es unter Zoloft nur 15 Fälle und in der Kontrollgruppe nur 2 Fälle.
Diese absoluten Zahlen finden sich in dem Zulassungsantrag von Pfizer (International Registration Dossier Seite 8, (18)). Aber auch hier wird das Risiko des Suizides unter Zoloft heruntergespielt und die Daten werden nicht statistisch analysiert.
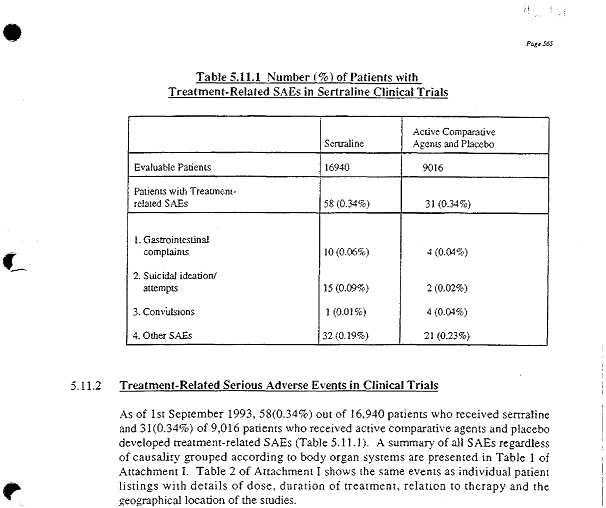
Der Gutachter Möller meinte auch im Gutachten, dass die Anzahlen zur Suizidalität in beiden Gruppen in etwa vergleichbar wären, Zoloft somit nicht das Suizidrisiko erhöhen würde. Diese Bewertung findet sich auch in seiner Schlussfolgerung:
In diesem Moment waren mir doch leichte Zweifel gekommen, ob ich nicht einem Phantom hinterherjage, das gar nicht existiert. Vielleicht war ja doch nichts an dem Verdacht, dass die SSRI- Antidepressiva das Suizidrisiko erhöhen, und falls doch, dann nur so geringfügig, dass dies kaum messbar und daher irrelevant sei.
Doch bei den Angaben im Gutachten und im Zulassungsantrag Pfizers hatte ich insgesamt den Eindruck, dass hier etwas nicht stimmen konnte. Es waren auch nicht nur die vergleichsweise wenigen Fälle, die mich stutzig machten, sondern dass mehr als die Hälfte dieser 15 Fälle unter Zoloft, so folgerte ich, vollendete Suizide gewesen sein mussten.
Aus den Anlagen zum Gutachten entnahm ich, dass es unter Zoloft mindestens 8 Fälle von vollendetem Suizid gegeben hatte. Da ich davon ausgegangen bin, dass sämtliche Suizide bei den 15 Fällen von Suizidalität mit eingerechnet sein müssten, wäre mindestens jeder zweite Fall von Suizidalität ein durchgeführter Suizid. Doch normalerweise enden die meisten Suizidversuche nicht tödlich, so dachte ich.
Der zweite Punkt war, dass die Studien an Probanden mit psychischen Störungen durchgeführt wurden, meistens mit Depressionen oder mit Zwangsstörungen, die per se ein erhöhtes Suizidrisiko haben. Hätte die gesamte Anzahl von Suizidalität dadurch nicht sehr viel größer sein müssen, als die insgesamt 17 Fälle, die im Gutachten und im Zulassungsantrag genannt werden, egal ob unter Zoloft oder in der Kontrollgruppe?
Doch ganz gleich ob es nun 15 Fälle unter Zoloft waren oder mehr, es waren in jedem Fall unter Zoloft relativ viel mehr als in der Kontrollgruppe. Eine statistische Auswertung im Gutachten zum Risiko von Zoloft hätte dies auch feststellen müssen, wenn es denn eine gegeben hätte.
Aussagen werden nicht durch Daten belegt
In jeder Studie und in jedem medizinischen Fachartikel werden Aussagen zur Wirkung und zu den Risiken von Medikamenten mit statistischen Daten belegt. Da finden sich Konfidenzintervalle und p-Werte, aus denen sich die Irrtumswahrscheinlichkeit für die aufgestellten Hypothesen ergeben.
Im Gutachten sucht man derartige Analysen vergeblich. Wie wahrscheinlich ist zum Beispiel die vom Gutachter gefolgerte Ansicht, dass Zoloft das Suizidrisiko nicht erhöht, also das relative Risiko von Zoloft im Vergleich zur Kontrollgruppe kleiner als 1 ist? Nach meinen eigenen Berechnungen belegen die Daten ein höheres Risiko von Suiziden unter Zoloft mit einer Sicherheit von 99 Prozent! Die Daten widersprechen also den Folgerungen des Gutachters.
In einem wissenschaftlichen Artikel ist Usus, dass man seine Aussagen nachprüfbar anhand der vorliegenden Daten belegen muss. Müsste dies nicht erst recht auch für die Risikobewertung im Zulassungsgutachten gelten, bei dem die Gesundheit und das Wohlergehen der Patienten auf dem Spiel stehen?
Das Arzneimittelgesetz fordert im Zulassungsverfahren eine Prüfung des Medikamentes nach dem Stand der Wissenschaft. Diese hat es jedoch wahrscheinlich nicht gegeben. Die Aufsicht sah darüber hinweg und tut dies immer noch.
Schadenersatzurteil gegen Möller im Teppichhändler-Prozess.
Die Untersuchung des Arzneimittels Zoloft in dem Gutachten erfolgte in etwa so, wie wenn ein Arzt ohne genaue Anamnese des Patienten eine Diagnose erstellt, einfach nur aufgrund des äußerlichen Eindrucks.
Aber auch dies ist Hans Jürgen Möller nicht fremd, wie der so genannte Teppichhändler-Prozess gezeigt hat. Der ein oder andere Leser wird vielleicht hiervon gehört haben. Professor Möller wurde im Jahr 2010 vom Oberlandesgericht München wegen Verletzung des Persönlichkeitsrechts zu einem Schmerzensgeld von 5.000 EUR verurteilt, da er ein psychiatrisches Gutachten über den Teppichhändler Eberhard Herrmann unberechtigt an dessen Ehefrau weitergereicht hatte, wie die Münchener Abendzeitung schrieb (19).
In diesem Gutachten wurde der Teppichhändler von Möller für verrückt erklärt, ohne ihn vorher untersucht zu haben. Es war für die Vorlage bei der zuständigen Polizeibehörde vorgesehen und empfahl die Unterbringung in einer psychiatrischen Einrichtung (20). „Ich sehe, Sie sind geisteskrank“, so der Untertitel in der Süddeutschen Zeitung.
Das zweifelhafte Gutachten von Möller bei der Zulassung von Zoloft ist für ihn bisher ohne Folgen geblieben. Es wurde ohne Nachfragen von der Aufsichtsbehörde akzeptiert. Das liegt auch daran, dass die Gutachten geheim gehalten werden können und der interessierten Fachwelt und der breiten Öffentlichkeit nicht zugänglich sind. Genau aus diesem Grund habe ich Teile des Gutachtens zu Zoloft in meinem Blog veröffentlicht (21) und darüber geschrieben. Die Gesundheit der Menschen ist einfach zu wichtig und geht uns alle an, als dass man sie nur den vermeintlichen Experten und Gutachern überlassen kann.
Androhung einer Klage von Pfizers Anwälten
Bei den Anwälten der Gegenpartei und beim Richter am Oberlandesgericht Köln kam dies, wie Sie sich vielleicht denken können, nicht gut an. Die Pfizer-Anwälte von der Kanzlei Lovells drohten mir mit Klage wegen meiner Veröffentlichungen aus dem Gutachten im Internet. Bis heute ist es jedoch bei der Androhung geblieben, eine Klage gegen mich wurde bisher nicht eingereicht. Da hatte man wohl doch die Befürchtung, dass dies ein großes Medienecho nach sich ziehen könnte und eine Klage – aus Sicht des Unternehmens – eher kontraproduktiv wäre.
Ein Berg von Akten
Die Arzneimittelaufsichtsbehörde BfArM musste für meinen Termin im Juni 2009 sämtliche Akten zu Zoloft physisch wiederherstellen, denn sie waren inzwischen vernichtet worden und nur noch auf Mikrofilm vorhanden. Es waren circa 70 Akten, die ausgedruckt und neu angefertigt werden mussten. Man hätte sie hierbei auch gleich digitalisieren und mir die Datenträger aushändigen können, was man aber nicht wollte. Wahrscheinlich hätten die Anwälte Pfizers dies vehement abgelehnt, da sie so keine Kontrolle über die Informationen gehabt hätten.
Es war somit für das BfArM viel Arbeit und die Mitarbeiter des BfArM gaben sich redlich Mühe, mir die Einsichtnahme zu ermöglichen. Die Aufsichtsbehörde hatte hiermit noch keine Erfahrung, waren doch sämtliche 160 Anträge vor dem meinen abgelehnt worden (22). Nach zwei Tagen hatten wir zahlreiche Unterlagen markiert und bekamen diese – nachdem die Anwälte von Pfizer sie noch einmal gesichtet hatten – nach ein paar Wochen in Kopie zugeschickt. An wenigen Stellen waren die Unterlagen geschwärzt. So war zum Beispiel der Name des Gutachters, der bei der Akteneinsicht noch lesbar war, unkenntlich gemacht worden.
Zwei Akten mit Meldungen schwerer Nebenwirkungen
In den Unterlagen fanden sich auch zwei Akten voller Meldungen zu schweren Nebenwirkungen durch das Medikament Zoloft, in der Regel Fälle von Suizidversuchen und Suiziden.
Die ersten Fälle wurden gemeldet, nachdem das Medikament erst seit wenigen Monaten zugelassen war. Zu jedem Fall wurde, neben der Beurteilung durch den Arzt, auch das pharmazeutische Unternehmen um eine Stellungnahme gebeten. Diese Bewertung lautete fast immer gleich: „Aufgrund des vorliegenden Berichts sind unseres Erachtens derzeit keine Maßnahmen geboten“, heißt es dort wiederholt, oder etwas ausführlicher:
„Es besteht ein zeitlicher Zusammenhang zwischen der Verabreichung unseres Präparates Zoloft und der Entwicklung der oben geschilderten Symptomatik (…). Einen unmittelbaren kausalen Zusammenhang zwischen Zoloft und dem Suizidversuch nehmen wir nicht an. Wir sehen derzeit keinen Anlass für eine geänderte Bewertung des Risiko-Nutzenverhältnisses“.
So ging es über viele Jahre. Immer wieder wurden Fälle von Suiziden und Suizidversuchen unter Zoloft gemeldet. Bei einigen von ihnen wurde ein kausaler Zusammenhang vom Arzt als möglich oder wahrscheinlich erachtet – alle wurden vom Unternehmen abgetan; Maßnahmen seien nicht erforderlich. Diese Bewertungen durch Pfizer wurden von der Aufsichtsbehörde akzeptiert, abgeheftet und das war es. Kritische Nachfragen hat es nicht gegeben. Mit Arzneimittelüberwachung durch die Behörde oder Pharmacovigilance, wie der Fachbegriff hierfür heißt, hat dies nichts zu tun.
Die Aufsicht unternimmt nichts
Man hätte nun glauben können, dass die Behörde sich die Unterlagen nun noch einmal kritisch anschauen würde, bevor sie sie an uns verschickt, ob vielleicht doch Konsequenzen für die Zulassung gezogen werden müssten.
Doch dies ist nicht geschehen, wie ich auch nicht anders erwartet hatte. Denn ansonsten müsste man möglicherweise eine früher getroffene Entscheidung revidieren und hiermit das Feld für ähnlich gelagerte Fälle öffnen. Also wird alles Erdenkliche unternommen, um den Schein der Rechtmäßigkeit und einer wirklichen Aufsicht aufrechtzuerhalten.
So ist letztlich auch mein Termin der Akteneinsicht bei der Behörde zu sehen, denn damit kann man wunderbar bei den Medien in Sachen Transparenz punkten. Gleichzeitig wird aber alles Mögliche unternommen, um wirkliche Konsequenzen – wie zum Beispiel die Rücknahme einer Zulassung – zu verhindern.
Bei dem Bottroper Apotheker, der wegen gepanschter Krebsmedikamente vor wenigen Tagen zu 12 Jahren Haft verurteilt wurde, war das Landgericht Essen nicht so zimperlich wie die Aufsichtsbehörden in meinem Fall. „Verstoß gegen das Arzneimittelgesetz klingt nicht so anschaulich wie Körperverletzung oder gar Mord. Aber es ist ein scharfes Schwert, und hier ist es der Rettungsanker, der eine gerechte Bestrafung ermöglicht", so der vorsitzende Richter (24). Dem ist nichts hinzuzufügen.
Warum stellen sich die Aufsichtsbehörden, die Gerichte und auch die Bundesregierung schützend vor die pharmazeutischen Unternehmen, – wie die frühere gesundheitspolitische Sprecherin der LINKEN Kathrin Vogler im letzten Jahr geäußert hat (25)– , während der Bürger bei Rechtsverstößen mit der vollen Härte des Gesetzes bestraft wird – in dem Bottroper Apothekerskandal auch völlig zu Recht?
Zeigt sich auch hier das Doppelgesicht und die Doppelmoral unseres Staates: Nachsichtig und liberal gegenüber den Mächtigen und Eliten auf der einen Seite und zunehmend repressiv gegenüber den Bürgern auf der anderen Seite?
Der jetzige Präsident der Aufsichtsbehörde BfArM Professor Karl Broich hat gegenüber der Apothekerzeitung Apotheke AdHoc auf einer Konferenz einmal geäußert, dass das BfArM Partner der Industrie sein müsse (23). Diese Haltung unserer staatlichen Institutionen macht vieles von dem, worüber ich noch berichten werde, verständlich.
Diese meine Einschätzung, dass die Behörde mehr auf Seiten der Industrie als auf Seiten der Bürger steht, mag hart und den Mitarbeitern gegenüber, die größtenteils ehrlich und gewissenhaft ihren Job machen, ungerecht erscheinen. Auch ich wurde von den Mitarbeitern immer freundlich und zuvorkommend behandelt und kann mich daher über eine schlechte Behandlung nicht beschweren.
Als ich die Aufsichtsbehörde im Jahr 2009 darüber unterrichtete, dass die Zahlen im Gutachten auf ein höheres Suizidrisiko unter Zoloft hindeuten würden, erhielt ich zur Antwort, dass man die Beurteilung des Risikos nicht einfach auf eine Kenngröße reduzieren kann, sondern immer die Umstände des Einzelfalles zu berücksichtigen habe. Mit anderen Worten: Nicht die Daten aus den Studien und eine quantitative und qualitative Analyse sind entscheidend, sondern die Beurteilung jedes Einzelfalls.
Diese Argumentation ist aber genau das Gegenteil dessen, was die Gerichte sagen und was die Pharmaunternehmen in der Öffentlichkeit jahrelang zuvor behauptet haben, dass man einen kausalen Zusammenhang im Einzelfall nicht zweifelsfrei feststellen kann, weil immer auch andere Ursachen möglich sind.
Andererseits zählt in einer gerichtlichen Klage oder Strafanzeige nach geltender Rechtsprechung immer nur der Einzelfall. Ob sich durch Studien beweisen lässt, dass ein bestimmtes Medikament mit hoher Wahrscheinlichkeit risikoerhöhend ist, ist daher für sie irrelevant.
Die Hoffnung stirbt zuletzt
Als Betroffener beziehungsweise Angehöriger ist man somit in einem Dilemma und einer ziemlich ausweglosen Situation, wenn die Gerichte und Behörden sich in ihrer Argumentation zum Teil widersprechen.
Doch die Beurteilung der Sach- und Rechtslage durch die Gerichte und Behörden kann sich auch irgendwann, unter bestimmten Umständen, wieder ändern, denn sie ist nicht unabänderlich wie die Naturgesetze, wie jetzt das Essener Gericht gezeigt hat.
Dies ist meine Hoffnung und Motivation, warum ich trotz all der Widerstände nicht aufgebe und weitermachen werde. So wie Martin Luther, der für seine Überzeugungen gegen viel größere Widerstände kämpfen musste. Er soll einmal gesagt haben, dass er noch heute ein Apfelbäumchen pflanzen würde, auch wenn er wüsste, dass morgen die Welt untergeht. Genauso wie er, so gebe auch ich die Hoffnung nicht auf.
Quellen und Anmerkungen:
(1) Focus-Magazin vom 01.08.1994, Heft 31, Aids Skandal ,Tödlicher Cocktail
https://www.focus.de/politik/deutschland/aids-skandal-toedlicher-cocktail_aid_148531.html
(2) Deutscher Bundestag: Drucksache 13/1832 vom 28.06.1995
http://dip21.bundestag.de/dip21/btd/13/018/1301832.asc
(3) Interview John Virapen auf Planet Interview vom 2.3.2009
http://www.planet-interview.de/interviews/john-virapen/34852/
(4) Fax Eli Lilly, Bad Homburg an US-Zentrale, 25.05.1984 https://www.dropbox.com/s/mn1x4e67ghw42py/1984%20Fax%20to%20Lilly%20Headquarter%20from%20%20Bad%20Homburg%20%28PROZAC%29.pdf?dl=0
(5) Süddeutsche Zeitung , Wochenendbeilage ,16./17.02.2013,
http://www.n-fuchs.de/artikel/Antidepressiva_Sueddeutsche.pdf
(6) Eli Lilly, Suicide Report for BGA, submitted in December 1986
https://www.dropbox.com/s/fv0vplr1bj6aul3/1986%20Suicidereport_for_BGA_from_Eli_Lilly.pdf?dl=0
(7) BGA, 2.Versagung der Zulassung für Fluctin vom 26.04.1988
https://www.dropbox.com/s/yukazjkee3eul9d/1988-04-26%20Zweite%20Versagung%20der%20Zulassung%20von%20Fluctin%20durch%20das%20BGA.pdf?dl=0
(8) Antidepressants' Black-Box Warning — 10 Years Later, The New England Journal of Medicine
https://www.nejm.org/doi/full/10.1056/NEJMp1408480
(9) SSRI und Suizidalität ? Deutsches Ärzteblatt vom 24.09.2004
https://www.dropbox.com/s/p40kqq93kgi9wym/Arzneimittelkommission%20der%20deutschen%20%C3%84rzteschaft%20Kurzfassung%20200409243.pdf?dl=0
(10) Aktennotiz Telefonische Rückfrage zum Zulassungsantrag von Zoloft, 13.05.1998,
https://www.dropbox.com/s/74vmp5s6umcx1cr/1996-04-01_Fachliche_Stellungnahme_BfArM_Zulassungsverfahren_Zoloft_Band%202_S3_bis_6.pdf?dl=0 , Seite 1
(11) Aktenvermerk zur „ungerechten“ Behandlung von Sertralin, 14.11.1995
https://www.dropbox.com/s/74vmp5s6umcx1cr/1996-04-01_Fachliche_Stellungnahme_BfArM_Zulassungsverfahren_Zoloft_Band%202_S3_bis_6.pdf?dl=0, Seite 3
(12) Aktenvermerk zur „ungerechten“ Behandlung von Sertralin, 14.11.1995
https://www.dropbox.com/s/74vmp5s6umcx1cr/1996-04-01_Fachliche_Stellungnahme_BfArM_Zulassungsverfahren_Zoloft_Band%202_S3_bis_6.pdf?dl=0, Seite 2
(13) Ergebnisniederschrift der 197. Sitzung der Kommission A am 07.10.1996
https://www.dropbox.com/s/k9wzwszu17ntykm/Sitzung%20197%20Zulassungskommission.pdf?dl=0
(14) Aktennotiz der Aufsicht zur Verfahrensabkürzung
https://www.dropbox.com/s/94dotawan5024sa/Notiz_Verfahrensabk%C3%BCrzung_1996-04-01.pdf?dl=0
(15) Gutachten Prof. Möller zu Sertralin (Medikamentenname: Zoloft)
https://www.dropbox.com/s/5jr6irwtvywtopj/Gutachten_zu_Sertraline_1995.pdf?dl=0
(16) Artikel von Prof. Möller mit Deklaration of Interest zu zahlreichen Pharmaunternehmen
https://www.dropbox.com/s/61vpbixif9b9via/artikel_M%C3%B6ller_suizidalit%C3%A4t.pdf?dl=0
(17) Gutachten Prof. Möller zu Sertralin (Medikamentenname: Zoloft)
https://www.dropbox.com/s/5jr6irwtvywtopj/Gutachten_zu_Sertraline_1995.pdf?dl=0, Seite 23
(18) International Registration Dossier ZOLOFT, Volume 2 Clinical Overall Summary, Section 5 Safety of Sertralin, 5.11 Serious and Spontainous Adverse Events in Patients Who Received Sertralin
https://www.dropbox.com/s/o4rzprpnru1dxlx/Section_5_Safety.pdf?dl=0, Seite 8
(19) Münchener Abendzeitung vom 4.2.2010 “Psychiater muss zahlen”,
https://www.dropbox.com/s/zpq8lc6q1275p94/2010_M%C3%B6ller_zu_Schadenersatz_verurteilt.pdf?dl=0
(20) Süddeutsche Zeitung vom 17.05.2010 : Bizarres Gutachten „Ich sehe, sie sind geisteskrank“
http://www.sueddeutsche.de/muenchen/2.220/bizarres-gutachten-ich-sehe-dass-sie-geisteskrank-sind-1.712497
(21) Gegen Pfizer, Blogspot, Gutachten
http://gegen-pfizer.blogspot.com/p/gutachten-zu-zoloft-sertraline.html
(22) You Tube , WDR Sendung Markt
https://www.youtube.com/watch?v=Cfzf4Ld0FHs&feature=youtu.be
(23) Apothekte AdHoc vom 27.04.2016 Broich. Wir sehen uns als Partner der Industrie
https://www.apotheke-adhoc.de/nachrichten/detail/politik/arzneimittelzulassung-broich-wir-sehen-uns-als-partner-der-industrie/?tx_ttnews%5BsViewPointer%5D=1
(24) Richter wirft Behörden Versagen bei Kontrollen vor. Rheinische Post Online, 6. Juli 2018
https://rp-online.de/nrw/panorama/bottroper-apotheker-muss-wegen-gepanschter-krebsmedikamente-12-jahre-in-haft_aid-23830841
(25) Zulassung von Antidepressiva weiter in der Kritik, DAZ-Online, 19.09.2017
https://www.deutsche-apotheker-zeitung.de/news/artikel/2017/09/19/zulassung-von-antidepressiva-weiter-in-der-kritik/chapter:3

Wenn Sie für unabhängige Artikel wie diesen etwas übrig haben, können Sie uns zum Beispiel mit einem kleinen Dauerauftrag oder einer Einzelspende unterstützen.

Oder unterstützen Sie uns durch den Kauf eines Artikels aus unserer Manova-Kollektion .



